Examen deArticle de recherche classique

Le virus respiratoire syncytial (VRS) et le métapneumovirus humain (HMPV) sont tdeux agents pathogènes étroitement apparentés au sein dePneumoviridaefamilleCes virus sont fréquemment confondus dans les cas d'infections respiratoires aiguës chez l'enfant. Bien que leurs manifestations cliniques se chevauchent, les données de surveillance prospective (2016-2020) de sept hôpitaux pédiatriques américains, portant sur 8 605 patients, révèlent des différences importantes concernant les populations à haut risque, la gravité de la maladie et la prise en charge clinique. Cette étude a utilisé un protocole prospectif actif avec prélèvement et analyse systématiques d'écouvillons nasopharyngés pour huit virus respiratoires, offrant ainsi la première comparaison à grande échelle en conditions réelles pour les pédiatres. En analysant les taux d'hospitalisation, les admissions en soins intensifs, le recours à la ventilation mécanique et les hospitalisations prolongées (≥ 3 jours), elle établit un référentiel épidémiologique pré-interventionnel essentiel à l'ère des nouvelles vaccinations contre le VRS (par exemple, vaccins maternels, anticorps monoclonaux à longue durée d'action) et jette les bases du développement futur d'un vaccin contre le HMPV.
Constat principal n° 1 : Profils à haut risque distincts
-Le VRS touche principalement les jeunes nourrissons :L'âge médian d'hospitalisation était de seulement 7 mois, 29,2 % des patients admis étant des nouveau-nés (0 à 2 mois). Le VRS est une cause majeure d'hospitalisation chez les nourrissons de moins de 6 mois, sa gravité étant inversement proportionnelle à l'âge.
-Le HMPV cible les enfants plus âgés et ceux présentant des comorbidités :L'âge médian d'hospitalisation était de 16 mois, avec un impact plus marqué chez les enfants de plus d'un an. Notamment, la prévalence de comorbidités (cardiovasculaires, neurologiques, respiratoires, etc.) était plus de deux fois supérieure chez les patients atteints d'HMPV (26 %) que chez ceux atteints de VRS (11 %), soulignant leur vulnérabilité accrue.
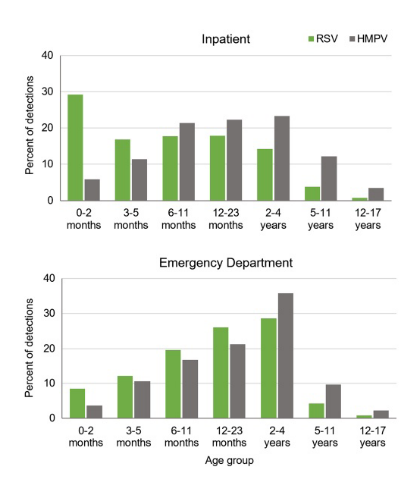
Figure 1. Répartition par âge des consultations aux urgences et des hospitalisationsassocié au VRS ou au HMPV
chez les enfants de moins de 18 ans.
Constat clé n° 2 : Différenciation des présentations cliniques
-Le VRS se manifeste par des signes respiratoires inférieurs marqués :Elle est fortement associée à la bronchiolite (76,7 % des cas hospitalisés). Les principaux indicateurs sont les suivants :rétractions de la paroi thoracique (76,9 % des patients hospitalisés ; 27,5 % des patients aux urgences)ettachypnée (91,8 % des patients hospitalisés ; 69,8 % des patients aux urgences), les deux étant nettement plus fréquents que dans le cas du HMPV.
-Le HMPV se manifeste par un risque plus élevé de fièvre et de pneumonie :Une pneumonie a été diagnostiquée chez 35,6 % des patients hospitalisés pour une infection à HMPV, soit le double du taux observé pour le VRS.La fièvre était un symptôme plus fréquent (83,6 % des patients hospitalisés ; 81 % des patients aux urgences).Bien que des symptômes respiratoires comme une respiration sifflante et une tachypnée surviennent, ils sont généralement moins graves que dans le cas du VRS.
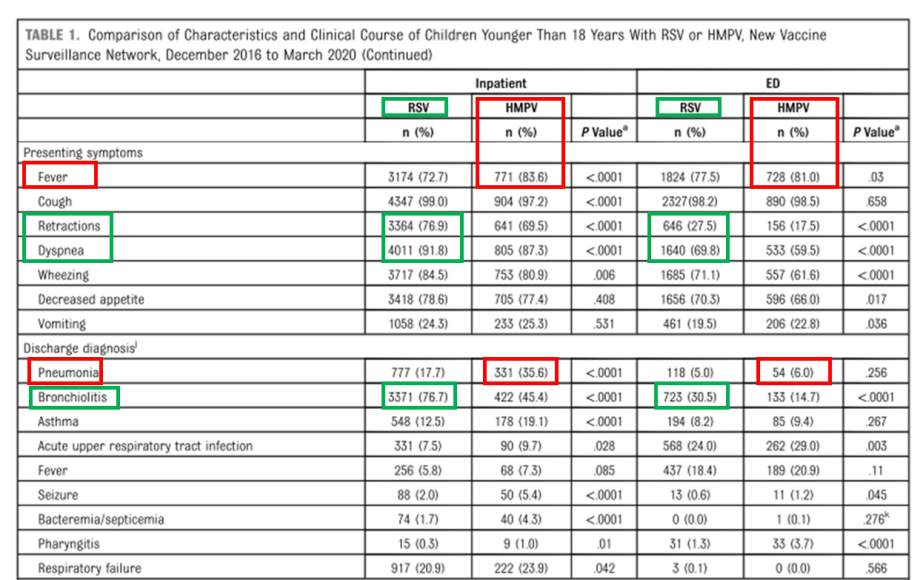
Figure 2.Caractéristiques comparatives et cliniquescoursdu VRS par rapport au HMPV chez les enfants de moins de 18 ans.
Résumé: VRSElle provoque principalement des maladies graves chez les jeunes nourrissons, caractérisées par une détresse respiratoire importante (respiration sifflante, tirage) et une bronchiolite.HMPVElle touche plus fréquemment les enfants plus âgés présentant des comorbidités, se manifeste par une fièvre prononcée, comporte un risque plus élevé de pneumonie et déclenche souvent une réponse inflammatoire systémique plus large.
Conclusion clé n° 3 : Les variations saisonnières sont importantes
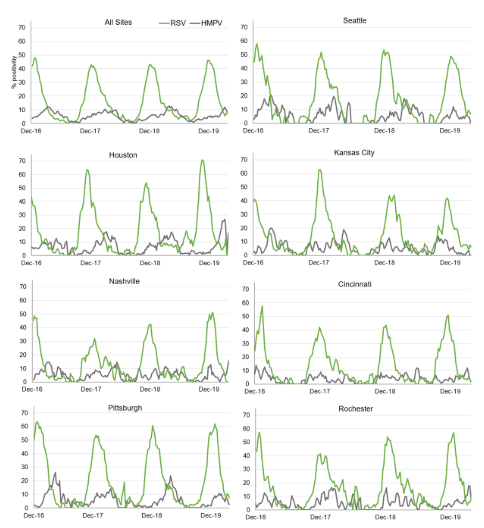
-Le VRS présente un pic précoce et prévisible :Son activité est très concentrée, atteignant généralement un pic entrenovembre et janvierce qui en fait la principale menace virale pour les nourrissons en automne et en hiver.
-Le pic de HMPV survient plus tard et avec une plus grande variabilité :Sa saison arrive plus tard, atteignant généralement son apogée enmars et avrilet présente des variations importantes d'une année à l'autre et d'une région à l'autre, apparaissant souvent comme une « deuxième vague » après le déclin du VRS.
Figure 3.PCR positive globale et spécifique au siteetaux de VRS et de HMPV chez les enfants de moins de 18 ans ayant consulté aux urgences et été hospitalisés pour une infection respiratoire aiguë (IRA).
Prévention et soins : un plan d'action fondé sur des données probantes
-Prophylaxie du VRS :Des stratégies de prévention existent désormais. En 2023, la FDA américaine a approuvé un anticorps monoclonal à action prolongée (Nirsevimab), qui protège les nourrissons pendant leurs cinq premiers mois. De plus, la vaccination maternelle contre le VRS transmet efficacement des anticorps protecteurs aux nouveau-nés.
-Prophylaxie contre le HMPV :Il n'existe actuellement aucun médicament préventif homologué. Cependant, plusieurs vaccins candidats (par exemple, le vaccin combiné RSV/HMPV d'AstraZeneca) font l'objet d'essais cliniques. Il est conseillé aux parents de se tenir informés des mises à jour des autorités de santé publique.
Consultez immédiatement un médecin si vous présentez l'un de ces signes d'alerte :
-Fièvre chez les nourrissons :Température ≥38°C (100,4°F) chez tout nourrisson de moins de 3 mois.
-Fréquence respiratoire élevée :La fréquence respiratoire dépasse 60 respirations par minute chez les nourrissons de 1 à 5 mois, ou 40 respirations par minute chez les enfants de 1 à 5 ans, ce qui indique une détresse respiratoire potentielle.
-Faible saturation en oxygène :La saturation en oxygène (SpO₂) chute en dessous de 90 %, un signe critique de maladie grave observé dans 30 % des cas d'hospitalisation pour VRS et 32,1 % des cas d'hospitalisation pour HMPV dans l'étude.
-Léthargie ou difficultés d'alimentation :Une léthargie marquée ou une réduction de la consommation de lait de plus d'un tiers en 24 heures peuvent être des signes précurseurs de déshydratation.
Bien que distincts sur le plan épidémiologique et clinique, le diagnostic différentiel précis entre le VRS et le HMPV au moment de la prise en charge reste complexe. De plus, la menace clinique ne se limite pas à ces deux virus, puisque des agents pathogènes tels que la grippe A et un large éventail d'autres agents pathogènes viraux et bactériens menacent simultanément la santé publique. Un diagnostic étiologique rapide et précis est donc crucial pour une prise en charge adaptée, un isolement efficace et une allocation rationnelle des ressources.
Présentation du kit de détection combinée AIO800 + 14 pathogènes (PCR par fluorescence)(approuvé NMPA, CE, FDA, SFDA)
Pour répondre à cette demande,Système de détection d'acides nucléiques entièrement automatique Eudemon™ AIO800, combiné avec unpanel respiratoire de 14 pathogènes, offre une solution transformatrice — apportant une véritable« Échantillon en entrée, réponse en sortie »Diagnostic en seulement 30 minutes.
Ce test respiratoire complet détecteà la fois des virus et des bactériesà partir d'un seul échantillon, permettant aux professionnels de santé de première ligne de prendre des décisions de traitement éclairées, opportunes et ciblées.
Fonctionnalités clés du système qui comptent pour vos clients
Flux de travail entièrement automatisé
Moins de 5 minutes de manipulation. Aucun personnel moléculaire qualifié n'est requis.
- Résultats rapides
Un délai de traitement de 30 minutes est adapté aux situations cliniques urgentes.
- 14Détection multiplex d'agents pathogènes
Identification simultanée de :
Virus :COVID-19, grippe A et B, RSV, Adv, hMPV, Rhv, Parainfluenza types I-IV, HBoV, EV, CoV
Bactéries :MP,Cpn,SP
-Réactifs lyophilisés stables à température ambiante (2–30°C)
Simplifie le stockage et le transport, éliminant la dépendance à la chaîne du froid.
Système robuste de prévention de la contamination
11 mesures anti-contamination comprenant la stérilisation UV, la filtration HEPA et un flux de travail à cartouche fermée, etc.
L'identification rapide et exhaustive des agents pathogènes est essentielle à la prise en charge moderne des infections respiratoires pédiatriques. Le système AIO800, avec son panel PCR multiplex entièrement automatisé de 30 minutes, offre une solution pratique en première ligne. En permettant la détection précoce et précise du VRS, du HMPV et d'autres agents pathogènes clés, il permet aux cliniciens de prendre des décisions thérapeutiques ciblées, d'optimiser l'utilisation des antibiotiques et de mettre en œuvre des mesures efficaces de contrôle des infections, améliorant ainsi la qualité des soins et l'efficience du système de santé.
#RSV #HMPV #Rapide #Identification #Respiratoire #Pathogène #Échantillon-à-Répondre#TestMacroMicro
Date de publication : 2 décembre 2025